Epidemiologie von Krebserkrankungen
Das Kapitel zur Epidemiologie von Krebserkrankungen legt in dieser Ausgabe – nach einem Überblick über die häufigsten Tumorlokalisationen – den Schwerpunkt auf die Überlebenswahrscheinlichkeit nach einer Krebsdiagnose. Nach einer ausführlichen Beschreibung der Berechnungsmethode werden die Ergebnisse im Zeitvergleich dargestellt und wichtige Punkte zur Interpretation der Ergebnisse beschrieben. Die Geschichte und der Hintergrund der Krebsregistrierung in Österreich sowie Erklärungen zu den wichtigsten epidemiologischen Kennzahlen sind im 1. Österreichischen Krebsreport (2021) nachzulesen.
Die häufigsten Tumorlokalisationen in Absolutzahlen, 2019
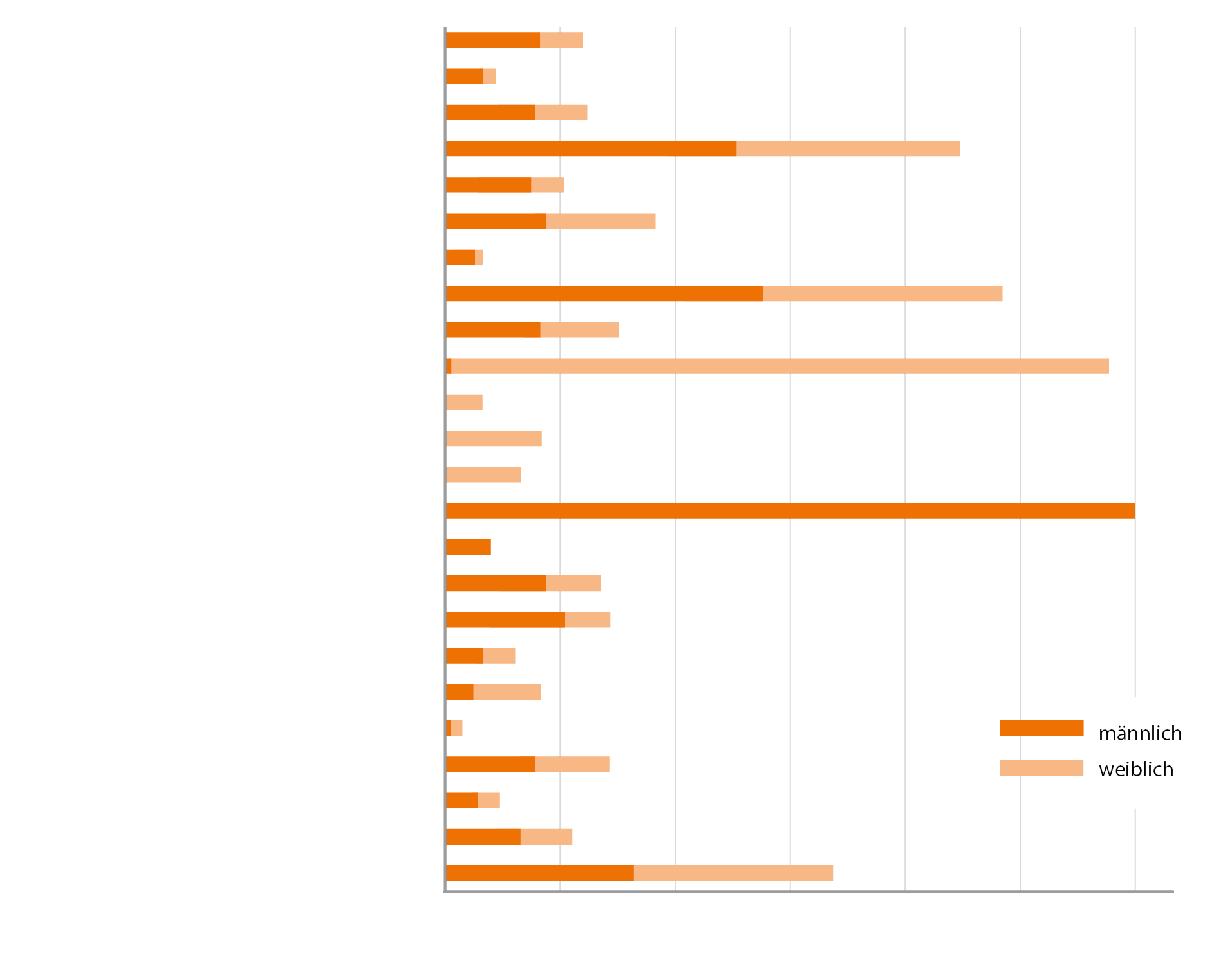
* B.N. = Bösartige Neubildung
„Im Jahr 2019 wurden in Österreich bei 41.775 Menschen Krebsneuerkrankungen dokumentiert, 22.614 bei Männern und 19.161 bei Frauen. Bei 10.926 Männern und 9.411 Frauen führte eine Krebserkrankung im Jahr 2019 zum Tod. Damit sind Krebserkrankungen für etwa ein Viertel der jährlichen Todesfälle verantwortlich. Tendenziell geht aber sowohl das Risiko einer Neuerkrankung als auch das Sterblichkeitsrisiko zurück. Zum Jahresende 2019 lebten in Österreich 375.749 Personen mit der Diagnose Krebs. Bei der Hälfte aller Erkrankten wurde ein Darm-, Lungen-, Brust- oder Prostatakrebs diagnostiziert, und zwar 4.444 bösartige Tumore des Dickdarms bzw. Enddarms, 4.831 Tumore der Lunge, 5.682 bösartige Tumore der Brust bei Frauen und 6.039 bösartige Tumore der Prostata bei Männern.“ (Krebserkrankungen in Österreich, 2020)
Fachleuten in Medizin und Forschung, Gesundheitspolitik bzw. -verwaltung sowie interessierten Laien wird weiterführend die Publikation „Krebserkrankungen in Österreich“ von Statistik Austria empfohlen. Diese stellt Erkrankungshäufigkeiten und -risiken, Sterblichkeit, Prävalenz und Überlebenswahrscheinlichkeiten für alle Malignome insgesamt und für 23 ausgewählte Tumorlokalisationen in kompakter und übersichtlicher Form dar und bietet so die Möglichkeit, sich aus erster Hand über das Krebsgeschehen in der österreichischen Bevölkerung zu informieren.
Aus den Daten zu den Krebsneuerkrankungen im Österreichischen Nationalen Krebsregister und den Sterbedaten der amtlichen Todesursachenstatistik bzw. des zentralen Melderegisters berechnet Statistik Austria Überlebenswahrscheinlichkeiten nach einer Krebsdiagnose.
Das sogenannte beobachtete Überleben (observed survival) wird nur anhand des Patientenkollektivs berechnet. Die Ausgangsmasse bilden alle in einem bestimmten Zeitintervall (im Beispiel: 2014–2018) diagnostizierten Tumorerkrankungen. Die Tumorerkrankungen können dabei nach verschiedenen Tumorlokalisationen oder Tumorentitäten gruppiert werden (im Beispiel: solide Tumore, ohne nicht-melanotischen Hautkrebs – NMSC, C44). Geschlecht, Alter oder Tumorstadium bei Diagnose können ebenfalls zur Gruppierung der Berechnungen herangezogen werden.
Unter Berücksichtigung der Alters- und Geschlechtsverteilung des Patientenkollektivs wird das Überleben der dieser Verteilung entsprechenden vergleichbaren Gruppe der Gesamtbevölkerung berechnet. Das erwartete Überleben (expected survival) bildet demnach die Überlebenswahrscheinlichkeit einer dem Patientenkollektiv vergleichbaren Gruppe der Gesamtbevölkerung ohne speziellen Fokus auf bestimmte Erkrankungen ab.
Das relative Überleben (relative survival) setzt das beobachtete Überleben der KrebspatientInnen in Beziehung zum Überleben der Gesamtbevölkerung. Ein relatives Überleben von 100% bedeutet, dass die Sterblichkeit unter den Erkrankten genauso hoch ist wie die Sterblichkeit in der allgemeinen Bevölkerung gleichen Alters und Geschlechts. Das relative Überleben ist somit ein von der spezifischen Todesursache unabhängiger Schätzer des krebsspezifischen Überlebens.
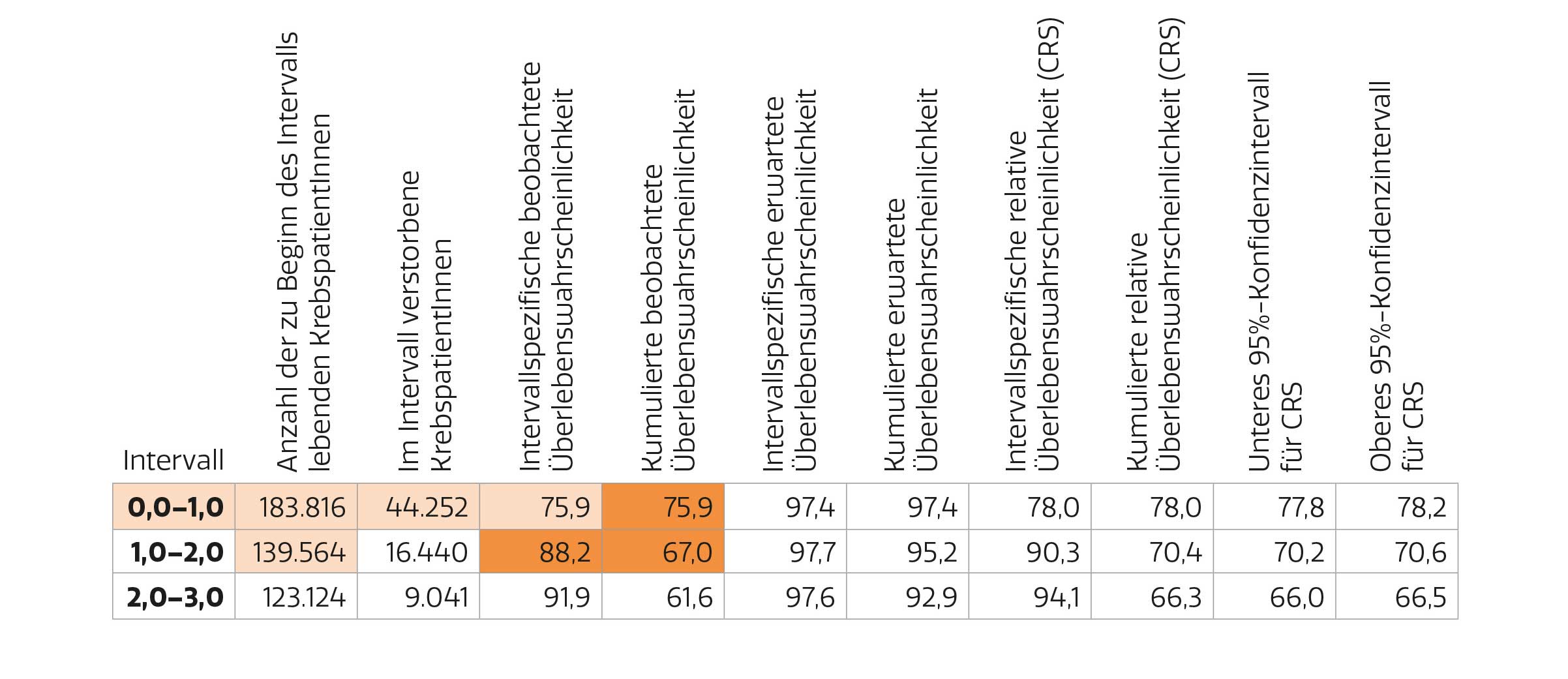
Diese Kennzahlen werden für jedes Jahr nach der Diagnose berechnet und anschließend über die Jahre kumuliert. Der Rechenvorgang wird am Beispiel des beobachteten Überlebens erklärt. Das intervallspezifische Überleben (interval-specific survival) entspricht der Wahrscheinlichkeit, das jeweilige Intervall zu überleben. Siehe dazu in der Beispieltabelle (S. 18) die 4. Spalte „Intervallspezifische beobachtete Überlebenswahrscheinlichkeit“ und die hellorange unterlegten Zellen. Zu Beginn des 1. Intervalls (0,0–1,0) sind 183.816 Personen am Leben, davon sterben im Laufe des Intervalls 44.252 Personen; damit sind am Ende des ersten Intervalls (wie auch am Anfang des zweiten Intervalls; 1,0–2,0) noch 139.564 Personen am Leben. Die Wahrscheinlichkeit, das erste Intervall zu überleben, beträgt daher 0,759 bzw. 75,9% (139.564 gebrochen durch 183.816). Diese Berechnung wird für jedes Intervall fortgesetzt. Um am Ende des zweiten Intervalls am Leben zu sein, muss die betroffene Person das erste und das zweite Jahr überleben. Da die Wahrscheinlichkeit für das Eintreten von zwei unabhängigen Ereignissen gleich dem Produkt der Einzelwahrscheinlichkeiten ist, werden die intervallspezifischen beobachteten Überlebenswahrscheinlichkeiten für das erste und das zweite Intervall multipliziert (siehe dazu die dunkelorange unterlegten Zellen). Die kumulierte beobachtete Überlebenswahrscheinlichkeit (cumulative observed survival) am Ende des 3. Jahres beträgt demnach 0.759 * 0.882 * 0.919 = 0,616 bzw. 61,6% (Rundungsdifferenzen nicht ausgeglichen).
Das kumulierte relative Überleben bildet das „Standardmaß“ für Überlebensdaueranalysen aus Krebsregisterdaten und wird auf der Webseite der Statistik Austria veröffentlicht (www.statistik.at/statistiken/bevoelkerung-und-soziales/gesundheit/krebserkrankungen).
Die Überlebenswahrscheinlichkeit nach einer Krebsdiagnose wird in der Krebsepidemiologie auch für den internationalen Vergleich über die einzelnen Jahre nach Diagnose kumuliert und relativ zum Überleben der Gesamtbevölkerung angegeben (https://ecis.jrc.ec.europa.eu/info/glossary.html).
Zusätzlich zu den Überlebenswahrscheinlichkeiten werden korrespondierende 95%-Konfidenzintervalle (95%-KI) berechnet. Konfidenzintervalle dienen dem Zweck, die Variabilität der gefundenen Ergebnisse basierend auf einer zufällig gezogenen Stichprobe aus der Grundgesamtheit zu quantifizieren. Würde man die Überlebenswahrscheinlichkeiten sehr häufig mit immer neuen, zufällig gezogenen Stichproben berechnen, würde das 95%-Konfidenzintervall für die Überlebenswahrscheinlichkeit aus einer konkreten Stichprobe die wahre, aber unbekannte Überlebenswahrscheinlichkeit der Grundgesamtheit mit 95%iger Wahrscheinlichkeit überdecken. Vergleicht man die Überlebenswahrscheinlichkeiten und deren Konfidenzintervalle von zwei Zeitperioden oder z.B. Tumorlokalisationen und überlappen sich dabei die Konfidenzintervalle stark, kann die Veränderung bzw. der Unterschied nur als Trend interpretiert werden, nicht jedoch als signifikante Zu- oder Abnahme. Überlappen sich die Konfidenzintervalle nicht oder nur geringfügig, gilt die Veränderung als auf dem 5%-Niveau signifikant (überzufällig).
Beispieltabelle
zur Berechnung von beobachtetem, erwartetem, kumuliertem und kumuliertem relativem Überleben für die Diagnoseperiode 2014–2018 und alle soliden Tumoren zusammen (C00–C43, C45–C80; ohne nicht-melanozytären Hautkrebs – NMSC, C44).
Für den Krebsreport wird das kumulierte relative 3-Jahres-Überleben dargestellt, um möglichst aktuelle Daten abbilden zu können. Mit dem Stichtag 19.01.2022 (Datum der Erstellung der aktuellen Datenbasis der Krebsstatistik), dem Jahr 2019 als letztes veröffentlichtes Diagnosejahr und dem Ende des Follow-ups am 31.12.2020 ergibt sich damit das Diagnosejahr 2018 als letztes für die Überlebenswahrscheinlichkeit nutzbares Berichtsjahr. PatientInnen, die im Jahr 2018 ihre Diagnose erhalten haben, können bis Ende 2020 zumindest zwei ganze Jahre und in Abhängigkeit vom genauen Diagnosezeitpunkt auch noch bis zu einem weiteren Jahr hinsichtlich ihres Überlebens nachverfolgt werden.
Für die Bewertung der zeitlichen Veränderungen werden zwei 5-jährige Diagnoseperioden verglichen. Die Zusammenfassung einzelner Diagnosejahre zu Perioden ist notwendig, um ausreichend große Fallzahlen in den einzelnen Gruppen und damit ausreichend schmale Konfidenzintervalle zu gewährleisten. Nur bei ausreichend großen Fallzahlen können aussagekräftige Werte ermittelt werden.
Das relative 3-Jahres-Überleben hat in den vergangenen Jahrzehnten zugenommen und liegt in der Diagnoseperiode 2014–2018 im Mittel bei rund 66%. Zu den wichtigsten Faktoren, die das Überleben nach einer Krebsdiagnose beeinflussen, gehören Tumorentität und Tumorstadium bei Diagnose. Da die Abgrenzung der Tumorentitäten stark vom aktuellen Stand der Forschung (Stichwort „Immuntherapie“ bzw. „personalisierte Medizin“) abhängt, werden bei der Analyse von Krebsregisterdaten Tumorlokalisationen, die sich in erster Linie aus dem betroffenen Organ bzw. aus Organgruppen ableiten, ausgewiesen.
Tumorlokalisationen mit guter Prognose sind vor allem Hoden und Schilddrüse. Hier beträgt die beobachtete Überlebenswahrscheinlichkeit für drei Jahre nach Diagnose eines bösartigen Tumors 96% bzw. 94%. In einer Gruppe der Gesamtbevölkerung mit demselben Altersaufbau wie die Gruppe der an Hodenkrebs erkrankten Patienten beträgt die Überlebenswahrscheinlichkeit 99%, für die Gruppe der an Schilddrüsenkrebs erkrankten PatientInnen 98%. Das heißt, dass in der Gesamtbevölkerung auch nicht alle Personen nach einem Beobachtungszeitraum von drei Jahren noch am Leben sind. Berücksichtigt man diese nicht durch Krebs bedingte Sterblichkeit (nämlich, dass KrebspatientInnen auch aus anderen Gründen versterben können), erhöht sich der Wahrscheinlichkeitswert auf 97% bzw. 96% (relative Überlebenswahrscheinlichkeit). Wenn man davon ausgeht, dass von einer Gruppe der Gesamtbevölkerung von 100 Personen nach drei Jahren immer noch 100 Personen am Leben sind, wären in der Gruppe der an Hodenkrebs erkrankten Personen noch 97 am Leben und in der an Schilddrüsenkrebs erkrankten noch 96.
Bösartige Tumoren der Prostata und der Brust zählen ebenfalls zu den Erkrankungen mit höheren Überlebenswahrscheinlichkeiten (beobachtete Überlebenswahrscheinlichkeit 87% bzw. 86%). Beim Prostatakrebs wird aufgrund des höheren Alters der Patienten der Unterschied zwischen beobachteter und relativer Überlebenswahrscheinlichkeit besonders deutlich.
3-jähriges kumuliertes Überleben (in Prozent), im Zeitvergleich
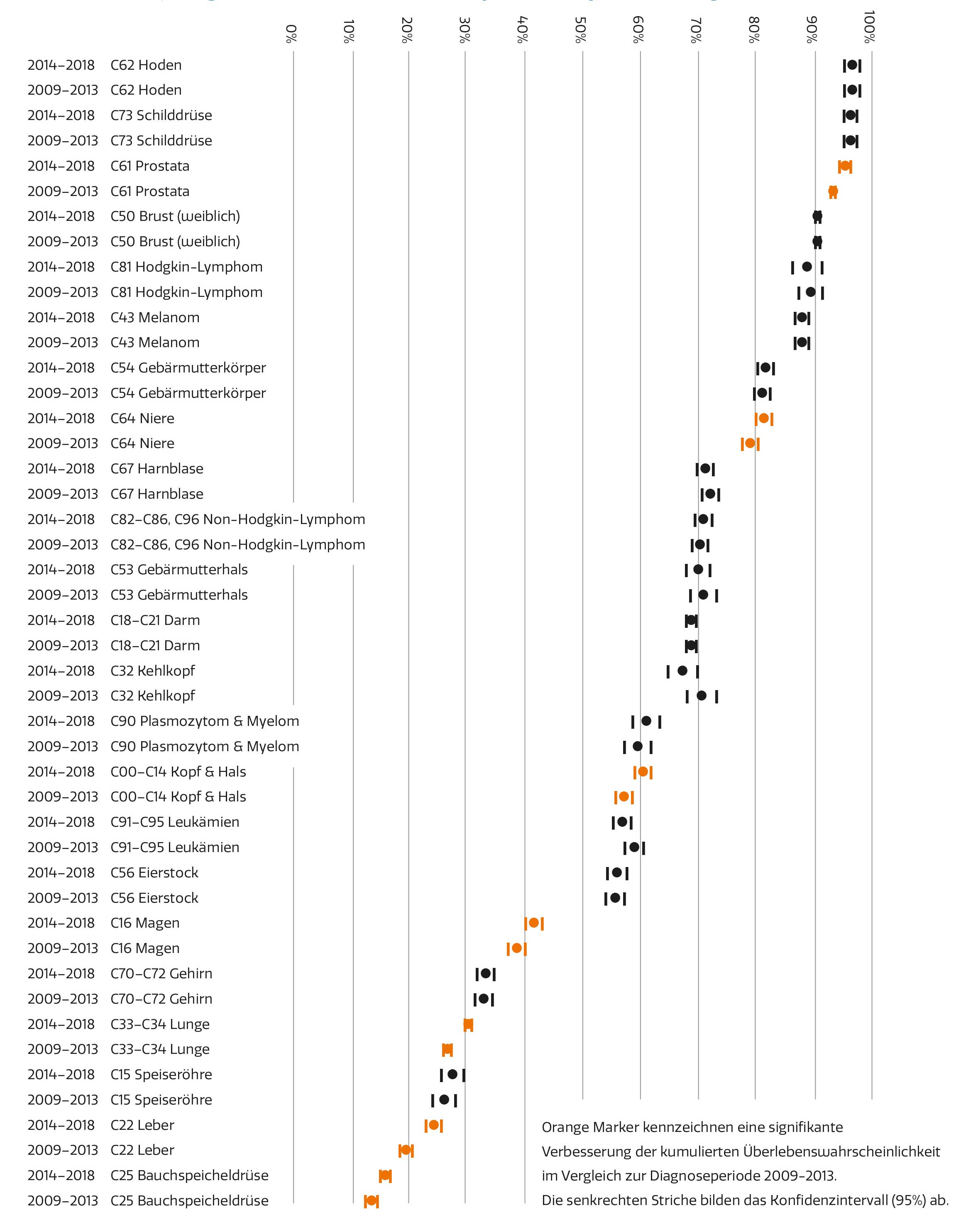
Berücksichtigt man das generelle Sterberisiko in einer altersentsprechenden Gruppe der Gesamtbevölkerung (erwartete Überlebenswahrscheinlichkeit 92%), beträgt die relative Überlebenswahrscheinlichkeit für diese Krebspatienten 95% (relative Überlebenswahrscheinlichkeit). Das bedeutet, diese Patienten haben einen Überlebensnachteil von 5% im Vergleich zur Gesamtbevölkerung.
Bösartige Tumoren der Lunge, der Speiseröhre, der Leber und der Bauchspeicheldrüse haben hingegen eine schlechte bzw. sehr schlechte Prognose. Die beobachteten Überlebenswahrscheinlichkeiten für drei Jahre nach der Diagnose betragen 28%, 26%, 22% und 14% bzw. bereinigt um das allgemeine Sterberisiko 30%, 27%, 24% und 16%.
Zwischen den Diagnoseperioden 2009–2013 und 2014–2018 kam es bei keiner einzigen Tumorlokalisation zu einer signifikanten Verschlechterung der Überlebenswahrscheinlichkeit. Signifikante Verbesserungen der Überlebenswahrscheinlichkeit zeigten sich bei folgenden Tumorlokalisationen: Prostata, Niere, Kopf & Hals, Magen, Leber, Lunge und Bauchspeicheldrüse.
Die nur für ein Drittel der Tumorerkrankungen (7 von 23) vorhandene Verbesserung des Überlebens nach drei Jahren ist – trotz aller Innovationen in der onkologischen Behandlung – für ExpertInnen nicht unerwartet. Zunächst ist festzuhalten, dass die Grafik alle PatientInnen einer Erkrankung erfasst, unabhängig davon, ob eine heilbare oder nicht heilbare Tumorerkrankung vorlag. Eine Verlängerung des Überlebens kann durch Folgendes erzielt werden:
1. Höhere Heilungschancen bzw. Verlängerung des Lebens durch Diagnosestellung in einem früheren Erkrankungsstadium
2. Höhere Heilungschancen bzw. Verlängerung des Lebens durch verbesserte Behandlung in heilbarer Situationen
3. Verlängerung des Lebens durch verbesserte palliative Therapie in nicht heilbarer Situation
Bei Nieren-, Lungen- und Lebertumoren (sog. hepatozelluläre Karzinome) sind die Verbesserungen im untersuchten Zeitraum vor allem durch wirksamere Medikamente in der palliativen Phase und nicht durch eine bessere Heilungschance zu erklären. Die Einführung der palliativen Therapie mit Checkpoint-Inhibitoren und zielgerichteten Substanzen ist vermutlich ausschlaggebend für die beobachteten Verbesserungen, auch wenn noch nicht ausreichend Daten vorhanden sind, um das beweisen zu können. Auch für Prostata-, Magen- und Bauchspeicheldrüsenkrebs ist anzunehmen, dass eher eine verbesserte medikamentöse Therapie in einer nicht heilbaren Erkrankungssituation den Ausschlag für das längere Überleben gegeben hat als eine Verbesserung der operativen Technik oder eine bessere Früherkennung.
Bei der Interpretation von Wahrscheinlichkeitswerten zum Überleben nach einer Krebsdiagnose muss bedacht werden, dass es sich um errechnete Werte basierend auf einer großen Gruppe von PatientInnen handelt, welche mit einer gewissen Unsicherheit (Konfidenzintervall) behaftet sind. Für eine einzelne Person können diese Werte lediglich eine grobe Orientierung hinsichtlich ihrer voraussichtlichen Überlebensdauer bieten. Alter, allgemeine Fitness bzw. andere vorhandene Erkrankungen (Komorbiditäten) sowie die Ausbreitung des Tumors bei Diagnosestellung und bestimmte spezifische Tumormerkmale haben einen großen Einfluss auf die individuelle Prognose.
Abgesehen von der Anwendbarkeit der Ergebnisse für einzelne Personen ist auch bei der Interpretation auf Bevölkerungsebene große Vorsicht geboten, da die Überlebenszeit von einigen patienten- und behandlungsunabhängigen Faktoren beeinflusst wird. Die wichtigsten Einflussfaktoren, welche zu einem sogenannten Bias, d.h. einer Verzerrung, führen können, sind die Vorlaufzeit der Diagnosestellung (lead time bias), die Überdiagnose (length time bias) und Veränderungen in der Genauigkeit der Diagnosestellung (stage migration). Diese Einflussfaktoren wirken sich direkt auf die Wahrscheinlichkeitswerte aus und können im Allgemeinen mit den Daten eines nationalen Krebsregisters nicht kontrolliert werden. Um den Einfluss abschätzen zu können, bräuchte es z.B. aufwendige randomisierte, prospektive kontrollierte Studien.
Die Verfälschung der berechneten Überlebenswahrscheinlichkeiten durch die Vorlaufzeit (lead time bias) ist insbesondere im Zusammenhang mit der Früherkennung von Krebserkrankungen relevant. Durch den früheren Diagnosezeitpunkt verglichen mit einer Diagnosestellung nach klinischen Symptomen wird zwar die Überlebenszeit länger, ob die PatientInnen jedoch tatsächlich insgesamt länger oder nur länger mit der Diagnose leben, kann mit der Maßzahl alleine nicht beantwortet werden. Facciorusso et al. beschreiben die Thematik sehr anschaulich in ihrer Anmerkung zu einem Paper von Govindarajan et al. zur Outcome-Analyse von PatientInnen mit Darmkrebs in Abhängigkeit von der Diagnosestellung (mit, nach bzw. ohne Kolonoskopie). Ein Hinweis für eine echte Verlängerung der Lebenszeit und einen tatsächlich späteren Tod wäre ein höheres durchschnittliches Sterbealter. Am Beispiel vom Prostatakrebs konnte das bereits anhand österreichischer Daten gezeigt werden: „Ziel eines Prostatakarzinom-Screenings ist die Verlängerung der Überlebensdauer. Allein durch das Vorziehen des Diagnosezeitpunktes verlängert sich in der Regel die Überlebensdauer – selbst wenn der Patient am selben Tag oder sogar früher verstirbt als ohne Screening. Betrachtet man das durchschnittliche Alter bei Diagnosestellung im Vergleich zum durchschnittlichen Alter zum Todeszeitpunkt, sieht man nicht nur eine Verlängerung des Überlebens, sondern auch eine deutliche Verschiebung des Todeszeitpunktes. Während 1983 das durchschnittliche Alter bei Diagnosestellung bei 75 Jahren und das durchschnittliche Alter zum Todeszeitpunkt bei 77 Jahren lag, waren es im Jahr 2011 im Schnitt 70 Jahre bei Diagnose und 82 Jahre bei Tod (altersstandardisiert auf die Bevölkerung 1983).“ (Hackl M, Karim-Kos H. Krebs:Hilfe, 2015:4)
Ebenfalls im Zusammenhang mit dem Screening besteht die Möglichkeit der Verfälschung der berechneten Überlebenswahrscheinlichkeiten durch Überdiagnose (length time bias). Durch Screening werden unter Umständen vermehrt bösartige Tumoren diagnostiziert, die langsamer voranschreiten oder im Extremfall nie Symptome verursacht hätten. Krebserkrankungen mit aggressivem Verlauf werden dagegen eher in den Intervallen zwischen den Untersuchungen aufgrund ihrer Symptome und somit unabhängig von Screening entdeckt.
„Eine Überdiagnose bedeutet, dass die Diagnose korrekt gestellt wird, aber die festgestellte Erkrankung lebenslang keine Symptome machen wird.“ (Concin H: Der Standard, 2019; www.derstandard.at/story/2000098372775/bluttest-zur-brustkrebsdiagnose-von-soll-noch-heuer-auf-den-markt; 22.09.2022)
Veränderungen in der Genauigkeit der Diagnosestellung können zur sogenannten stage migration führen und ebenfalls die berechneten Überlebenswahrscheinlichkeiten verfälschen. Inwieweit dieses Thema aktuell noch Gewicht hat, ist schwer abzuschätzen. Feinstein et al. erklären das Prinzip in ihrer Arbeit aus 1985 beim Vergleich zweier Kohorten – eine Gruppe LungenkrebspatientInnen wurde 1977 erstdiagnostiziert, die Vergleichsgruppe zwischen 1953 und 1964. Beschäftigt man sich mit Daten zu Überlebenswahrscheinlichkeiten von KrebspatientInnen, ist es jedenfalls essenziell, das Grundprinzip der stage migration wie auch der beiden anderen zuvor erwähnten Möglichkeiten eines Bias zu verstehen.
Werden durch verbesserte Diagnosemethoden Metastasen erkannt, die früher nicht erkannt worden wären, wird dieser Inzidenzfall der Gruppe „metastasiert bei Diagnose“ zugeordnet, während er früher in der Gruppe „nicht metastasiert bei Diagnose“ war. Dadurch „rutscht“ die erkrankte Person von einer Gruppe mit besserer Prognose in eine Gruppe mit schlechterer Prognose. In der Gruppe mit der besseren Prognose fällt eine Person weg, die tendenziell eine schlechtere Prognose als der Durchschnitt hat, und in der Gruppe mit der schlechteren Prognose kommt eine Person dazu, die tendenziell eine bessere Prognose als der Durchschnitt hat. Obwohl sich auf individueller Ebene die Überlebenswahrscheinlichkeit nicht verändert hat, wird durch die verbesserte Diagnostik die berechnete Überlebenswahrscheinlichkeit in beiden Gruppen höher.
Zusammenfassend kann gesagt werden, dass die Daten des Nationalen Krebsregisters Verbesserungen der Behandlung einzelner Krebserkrankungen aufzeigen können. Da im Register nur die Behandlungsintention und keine exakten Therapiedaten erfasst werden, sind keine Aussagen über den Grund der Veränderungen im Zeitverlauf möglich. Effekte wie stage migration oder lead/length time bias müssen bei der Betrachtung berücksichtigt werden, spielen aber bei der Betrachtung von kurzen, hintereinander liegenden und kurzen Intervallen (2014–2018 und 2019–2022) vermutlich nur eine geringe Rolle.
Monika Hackl, Karin Eglau,
Armin Gerger, Ansgar Weltermann
Literatur: - Facciorusso A, Ferrusquía J, Muscatiello N. Lead time bias in estimating survival outcomes. Gut 2016; 65:538–39 - Feinstein A, Sosin DM, Wells CK. The Will Rogers Phenomenon — Stage migration and new diagnostic techniques as a source of misleading statistics for survival in cancer. N Engl J Med 1985; 312:1604–08; www.nejm.org/doi/full/10.1056/nejm198506203122504 - Govindarajan A, Rabeneck L, Yun L et al., Population-based assessment of the outcomes in patients with postcolonoscopy colorectal cancers. Gut 2016; 65:971–76
 Nutzung von Cookies: Wir benötigen Ihre Einwilligung
Nutzung von Cookies: Wir benötigen Ihre Einwilligung