Der Wert der von der Pharmaindustrie geförderten klinischen Arzneimittelforschung und -entwicklung
Für eine Verbesserung der Behandlung von Krebserkrankungen ist Forschung & Entwicklung unverzichtbar. Der Blick auf die onkologische Arzneimittelforschung ist komplex und weist einige Besonderheiten auf. Einige Themen, bevor der Blick auf Österreich im Fokus steht:
- Im Vergleich zu anderen Therapiebereichen sind onkologische Studien deutlich komplexer, gemessen an der Zahl der Zulassungskriterien, Endpunkte, Prüfstellen, Länder und klinischen Proband:innen.1 Die Onkologie weist auch wenige Studienphasen auf, in denen administrative Tätigkeiten stattfinden – was letztlich die Zeit bis zur Markteinführung erfolgreicher Medikamente verkürzt.1
- Die Zahl der in Entwicklung befindlichen Produkte im Bereich der Onkologie ist in den letzten zehn Jahren erheblich gestiegen; derzeit befinden sich weltweit mehr als 2.000 Produkte in einer klinischen Phase der Entwicklung. Anzumerken ist jedoch, dass die Erfolgsquoten bei klinischen Studien in der Onkologie gering und seit 2015 sogar tendenziell rückläufig sind (das bedeutet, dass nur eine geringe Anzahl an klinischen Studien die nächste Phase erreichen konnte und nicht eingestellt, ausgesetzt oder zurückgezogen wurde). 2021 konnten nur 5,2% der Studien erfolgreich abgeschlossen werden, einzig bei seltenen Tumoren liegt die Quote mit durchschnittlich 15,6% etwas höher.1
- Dennoch konnte dank intensiver Forschung & Entwicklung (F&E) im Jahr 2021 weltweit die Rekordzahl von 30 neuartigen onkologischen Substanzen (NAS) auf den Markt gebracht werden. Seit 2012 wurden insgesamt 159 NAS eingeführt.1
- Diese innovativen Therapien stellen den größten Bereich der kollektiven Forschung dar und beinhalten auch einige der bahnbrechenden Erkenntnisse der Biowissenschaften. Sie eröffnen Patient:innen und betreuenden Onkolog:innen neue Behandlungsoptionen und geben oft auch neue Hoffnung. Dennoch sehen sich die Forscher:innen in forschenden Pharmaunternehmen, an den Universitäten und an den Forschungsinstituten mit großen Herausforderungen konfrontiert.
- Wir wissen aus den fundierten Einschätzungen der Expert:innen, dass bis 2040 von einer Verdoppelung der Krebspatient:innen auszugehen ist und dass die Therapien immer komplexer werden. Deshalb stellt sich die Frage: Wie können wir dem mit Forschung & Entwicklung gerecht werden? Wie kann es gelingen, klinische Studien nach Österreich zu bringen? Wie können die Strukturen in der heimischen Studienlandschaft gestaltet werden, um passende Rahmenbedingungen zu bieten?
Die Zahl der klinischen Studien befand sich in den letzten Jahren auf stabilem Niveau.
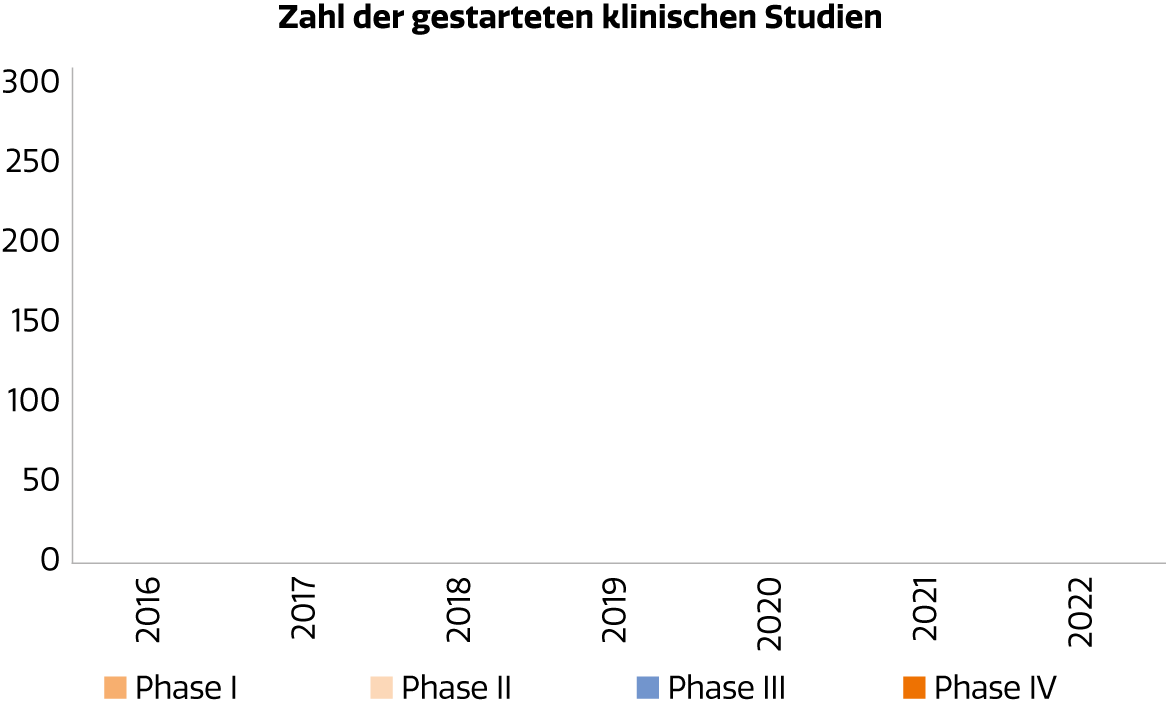
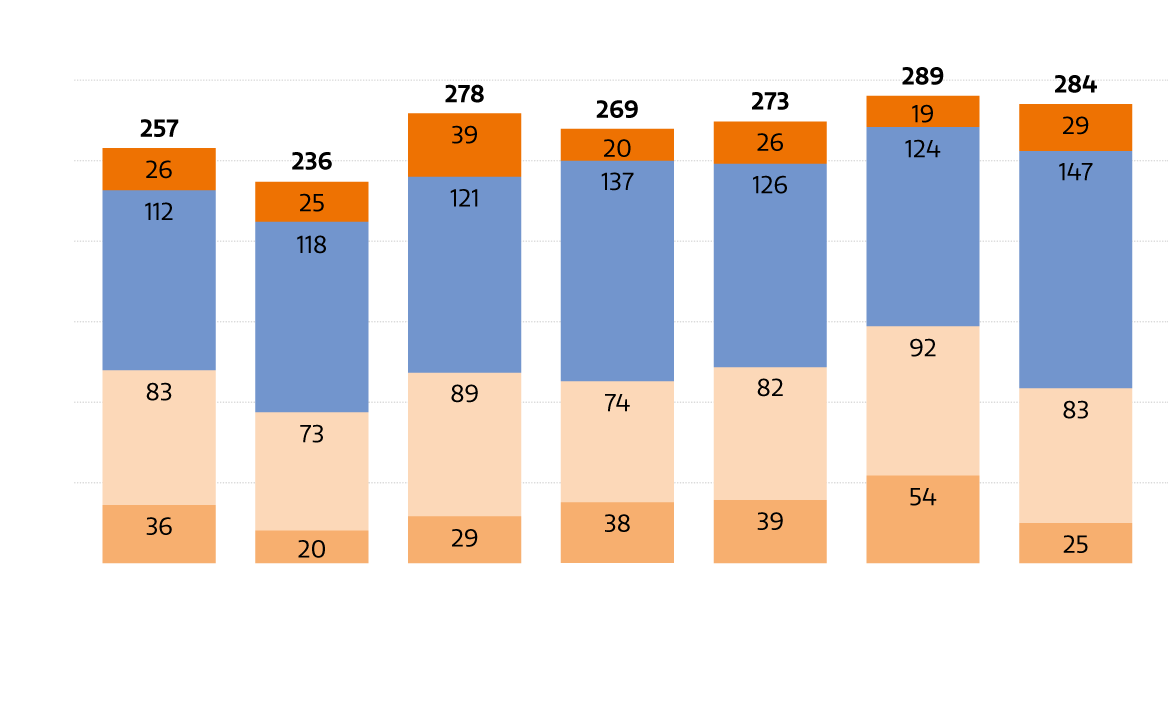
Abb. 1: Zahl der in Österreich gestarteten klinischen Studien
Löwenanteil der klinischen Forschung entfällt auf Onkologie
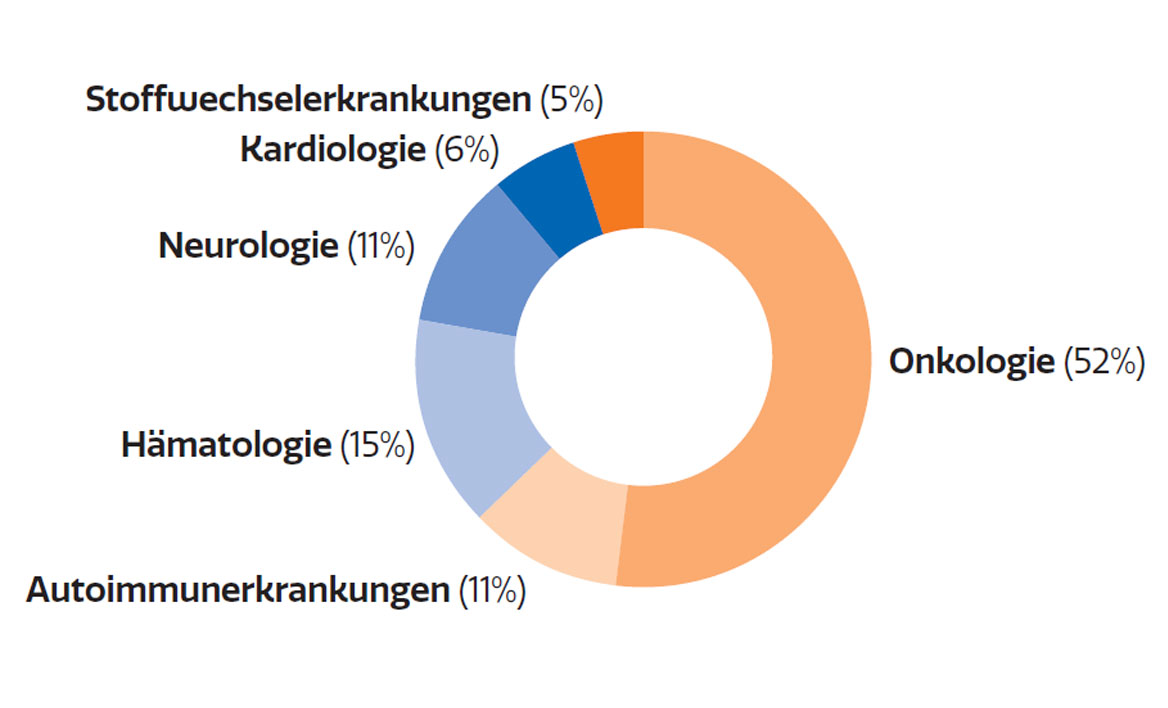
Abb. 2: Klinische Studien im Jahr 2020 nach den stärksten beforschten Indikationen (in %)
Klinische Forschung in Österreich
Unbestritten ist: Klinische Forschung findet auch im vergleichsweise kleinen Land Österreich statt. Erfreulicherweise erreichten die Studienstarts in Österreich im Jahr 2021 ein historisch hohes Niveau (+ 53% gegenüber 2017). Bemerkenswerterweise konzentrierten sich die Studien hauptsächlich auf seltene Krebsindikationen, bei denen trotz größerer Komplexität höhere Erfolgsquoten zu verzeichnen sind.1
Die Zahl der klinischen Studien, die jährlich an österreichischen Zentren gestartet werden, liegt bei zuletzt 284 Prüfungen. Davon entfallen 52% auf Phase-III-Studien, gefolgt von Phase-II-Studien mit 29% (Abb. 1). Nach Indikationen betrachtet, macht die Hämatologie & Onkologie den überwiegenden Anteil aller laufenden klinischen Studien aus und ist damit das am stärksten beforschte Segment (Abb. 2).
Das ist nicht nur als Beitrag zur internationalen Forschung zu werten, es ist auch ein direkter Benefit für das österreichische Gesundheitssystem. Denn die Beteiligung an klinischen Studien ermöglicht Patient:innen den Zugang zu neuesten Entwicklungen und gewährleistet eine engmaschige Betreuung. Weiters sind klinische Studien ein inhaltlicher Anreiz für Top-Ärzt:innen. Sie tragen zur Ausbildung junger Mediziner:innen bei, da damit die Befassung mit neuen, innovativen Substanzen im Zentrum steht.
Die klinische Forschung belebt außerdem die informellen Netzwerke innerhalb der Community. Und nicht zuletzt bringt sie dem Gesundheitssystem erwiesenermaßen Einsparungen, da die Medikamente von den forschenden Unternehmen finanziert werden. Laut einer Untersuchung des IPF – Institut für Pharmaökonomische Forschung werden 100,53 Mio. € an Behandlungskosten jährlich durch industriegesponserte klinische Prüfungen finanziert (bezogen auf die gesamten Ausgaben für medizinische Behandlungen inkl. aller Leistungen im Rahmen des klinischen Prüfplans und nicht nur auf die Prüfpräparate der klinischen Prüfung). Insgesamt generierten industriegesponserte klinische Prüfungen in Österreich im Jahr 2018 eine Wertschöpfung von 144 Mio. €.2 Neben all diesen Effekten sind klinische Studien aber vor allem eines: die Basis für pharmazeutische Innovationen. Als Folge intensiver Forschung & Entwicklung konnten in den letzten zehn Jahren über 400 innovative Arzneimittel in Österreich zugelassen werden (Abb. 3). Davon waren zuletzt 30% Onkologika (Abb. 4).
Über 400 innovative Arzneimittel mit neuem Wirkstoff in den letzten 10 Jahren – trotz Pandemie – in Österreich zugelassen!

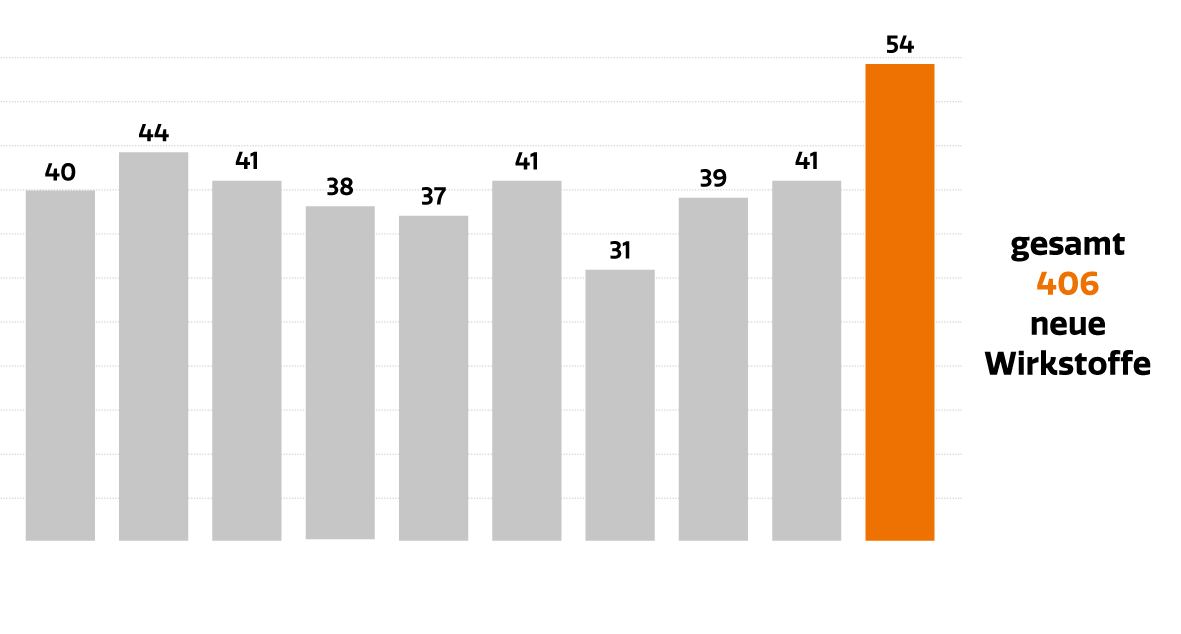
Abb. 3: Neu zugelassene Wirkstoffe in Österreich in den Jahren 2013–2022
Neue Wirkstoffe nach Klasse
2022
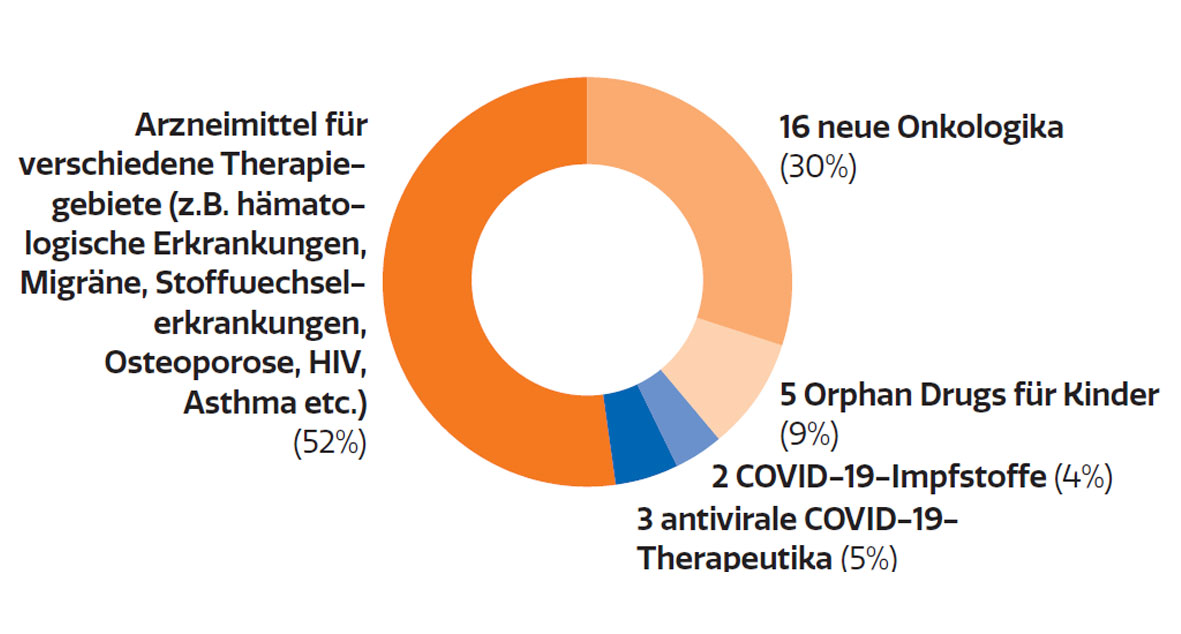
Abb. 4: Indikationsspektrum der 2022 in Österreich neu zugelassenen Arzneimittel
Herausforderungen der klinischen Forschung
Derzeit ist Österreich in der von der pharmazeutischen Industrie gesponserten klinischen Forschung international kompetitiv dabei. Es ist sicher darauf zu achten, dass sich hier die Rahmenbedingungen nicht verschlechtern. Seitens der forschenden Industrie wird wahrgenommen, dass viele Studienzentren über zu wenig Nachwuchs und Personalmangel klagen. Das ist ein Grund, warum Österreich als Studienstandort an Attraktivität verlieren könnte. Österreich verfügt zwar über eine hervorragende Ausbildung. Doch es ist oft schwer, gute Leute im Land zu halten. Eine stärkere Vernetzung der Spitäler in Österreich und die Einbringung von Patient:innen in Studien an anderen Standorten ist sicher notwendig, damit Österreich als Studienstandort attraktiver werden kann. Und nicht zuletzt fehlt es den Studienzentren teilweise an finanziellen Mitteln. Die Art und Weise, wie klinische Studien durchgeführt werden, wird sich in absehbarer Zeit bedeutend ändern. Die Digitalisierung und Telemedizin werden uns in den nächsten Jahren erlauben, klinische Studien im dezentralisierten Setting durchzuführen. Das heißt, dass Studienpatient:innen nicht mehr für jede Untersuchung ans Studienzentrum reisen müssen, sondern in der Nähe ihres Wohnorts dezentral betreut werden können.
Ein Blick über den Tellerrand
Klinische Forschung spielt für den Medizinstandort Österreich eine bedeutende Rolle. Doch pharmazeutische Forschung & Entwicklung ist generell – und in besonderem Maße in der Onkologie – in einem europäischen Kontext zu betrachten. Der Großteil der Studien findet multizentrisch statt und die wissenschaftliche Kollaboration passiert in großem Ausmaß länderübergreifend. Daher ist die Stärke Europas auf diesem Gebiet letztlich auch für heimische Patient:innen ausschlaggebend.
Aber Europa droht gegenüber den USA und China ins Hintertreffen zu gelangen. In China erhöhten sich die Ausgaben für F&E zuletzt jährlich um 12,9%. In den USA stiegen sie immerhin um 8,5%. In Europa wuchsen sie nur um 4% (Abb. 5). Das hat zur Konsequenz, dass mittlerweile 48% der neuen Therapien ihren Ursprung in den USA haben und nur 22% aus Europa stammen (Abb. 6). Während in den 1990er-Jahren die Hälfte aller innovativen Medikamente in Europa entwickelt wurde, ist es heute also nur mehr eines von fünf Medikamenten.
Ausgaben für pharmazeutische Forschung & Entwicklung: jährliche Wachstumsrate in %

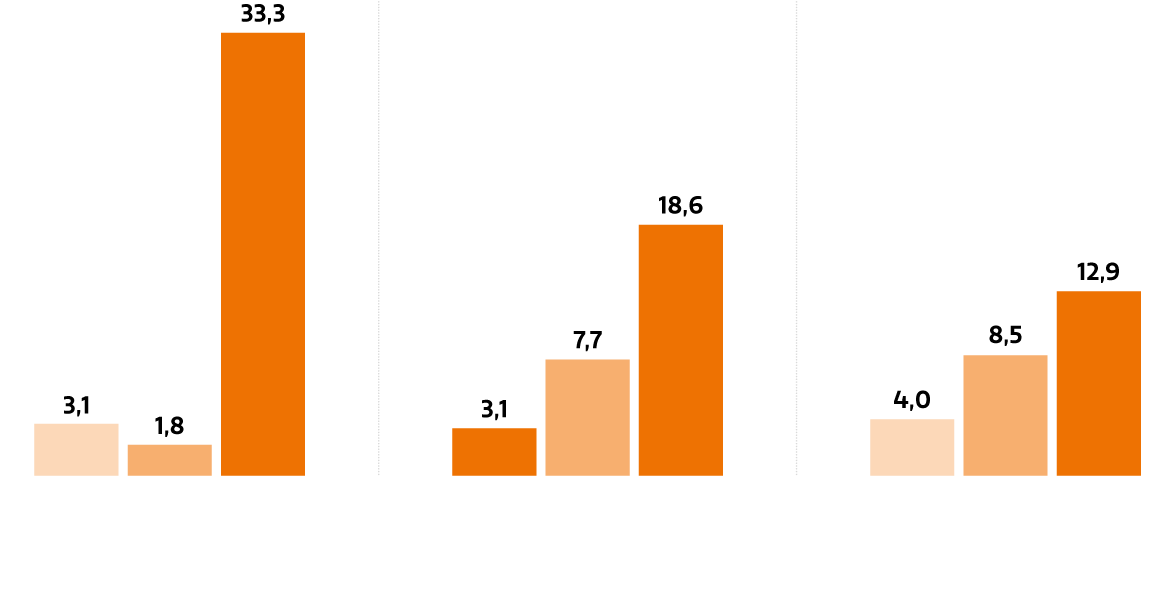
Abb. 5: Ausgaben für pharmazeutische Forschung & Entwicklung: jährliche Wachstumsrate in %
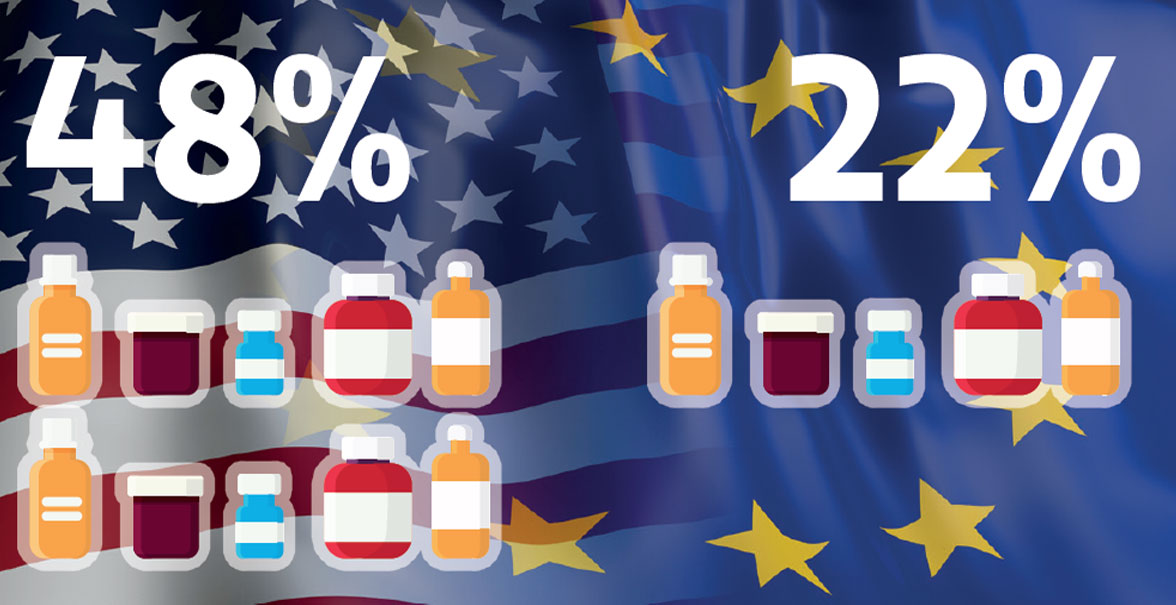
Abb. 6: Nur mehr eines von fünf neuen Medikamenten wurde 2022 in Europa entwickelt.
Stärkung europäischer Forschung – im Interesse der Patient:innen
Warum sollte uns das zu denken geben? Und warum sollten sich alle Entscheidungsträger:innen in den multinationalen sowie österreichischen Institutionen für eine Kräftigung der europäischen Forschung einsetzen? Weil Patient:innen nachweislich von onkologischer Forschung profitieren, und zwar viele schon in der Phase der klinischen Studien, da hier eine intensive medizinische Betreuung stattfindet und eine noch engere Vernetzung der Studienärzt:innen zu einem intensiven fachlichen Austausch führt. Daher muss der Forschungsstandort aus unserer Sicht nachhaltig gestärkt werden, was auch der Versorgungs- und Liefersicherheit dient. Der Vorschlag der EU-Kommission für eine neue EU-Arzneimittelgesetzgebung wird dem Anspruch aus Sicht des FOPI nicht gerecht – er konterkariert ihn sogar regelrecht. Die geplante gesetzliche Änderung soll die Besserstellung europäischer Patient:innen hinsichtlich Zugang zu Medikamenten, Versorgung mit moderner Medizin und Leistbarkeit von Arzneimitteln erzielen. Die Beschneidungen im Patentschutz sowie die zeitlichen Vorgaben für den uniformen Markteintritt ohne Berücksichtigung lokaler Strukturen und Prozesse dienen jedoch nicht dem Vorhaben einer zukunftsgerichteten, innovationsfreundlichen und wettbewerbsfähigen Pharmastrategie. Im Gegenteil, die neue Gesetzgebung könnte dazu führen, dass immer weniger forschende Unternehmen das Wagnis auf sich nehmen, hohe Summen in neue Ansätze zu investieren. Am Beispiel Patentschutz: Der Gesetzesvorschlag verkürzt den Schutz des geistigen Eigentums (Unterlagenschutz – Regulatory Data Protection) um zwei Jahre von 8 plus 2 auf 6 plus 2 Jahre. Innovativen Unternehmen wird damit die Zuverlässigkeit eines starken Schutzes des geistigen Eigentums zum Investitionszeitpunkt genommen. Das kann im Endeffekt zu weniger Investitionen in Innovationen für die Zukunft und zu einer Schwächung des Pharmastandortes Europas führen – wiewohl ein zukunftssicherer Rechtsrahmen grundsätzlich als sehr positiv zu bewerten ist. Gleichzeitig schwächt die Clinical Trial Regulation der EU die Position Österreichs: Die Verordnung über klinische Prüfungen (Clinical Trials Regulation –CTR) harmonisiert seit 2022 die Verfahren zur Bewertung und Überwachung klinischer Prüfungen auf multinationalem Level im EU-Raum. Online-Anträge für die Genehmigung zur Durchführung einer klinischen Prüfung in mehreren europäischen Ländern werden über eine einzige Online-Plattform namens Clinical Trials Information System (CTIS) eingereicht, wodurch die Durchführung solcher multinationalen Prüfungen effizienter wird. Dies ist zwar grundsätzlich positiv zu bewerten, doch Österreich verliert dadurch den langjährigen „Fast-Mover-Vorteil“.
Zusammenfassung
Neben der besseren Behandlung durch neue Medikamente kommen große Herausforderungen auf Europa und auch Österreich zu, denen man jetzt begegnen sollte. Es wäre daher sinnvoll, in einem Schulterschluss mit den Stakeholdern des heimischen Gesundheitswesens eine Reihe von konkreten Maßnahmen ins Leben zu rufen. Es gilt administrative und regulatorische Hürden abzubauen, die Bereitschaft der Bevölkerung für die Beteiligung an Studien zu forcieren und das Vertrauen von potenziellen Studienteilnehmer:innen zu untermauern sowie die Durchführung von klinischen Studien zu fördern – und zwar konkret nicht durch Subventionen, sondern durch einen unterstützenden Ordnungsrahmen. Zusammengefasst bedeutet das: Forschung & Entwicklung muss in Österreich stärker wertgeschätzt werden.
Ines Vancata im Namen des FOPI (Forum der forschenden pharmazeutischen Industrie)
1 IQVIA – Institute for Human Data Science (2022): Global Oncology Trends 2022. Outlook to 2026 (Success rates are calculated as the percentage of products reaching a subsequent phase in the year out of the total products with an outcome including those which are discontinued, suspended or withdrawn as well as those which have been inactive for three years. The date three years after the last update determines which year the drug is considered to have gone inactive and become included in the denominator of the success rate, except when desk research has concluded the drug is still in active research.)
2 Walter E et al. (2020): Economic impact of industry-sponsored clinical trials of pharmaceutical products in Austria